Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
-
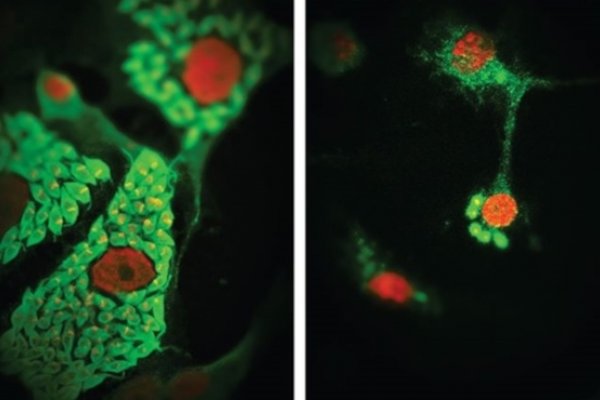 Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
-
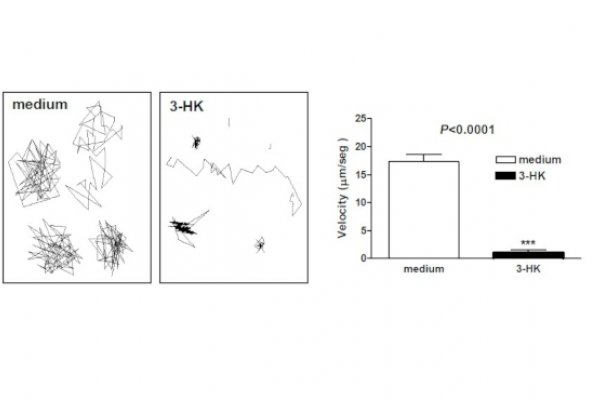 Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
-
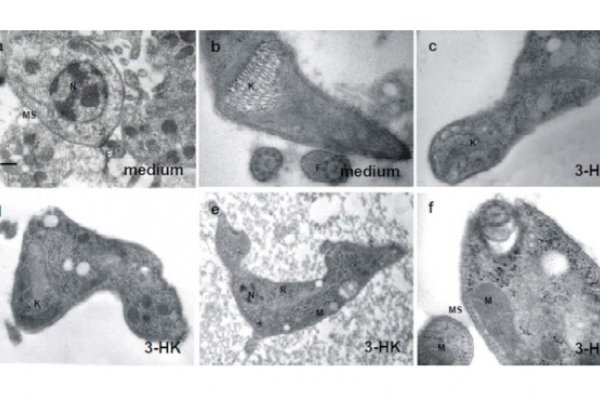 Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
-
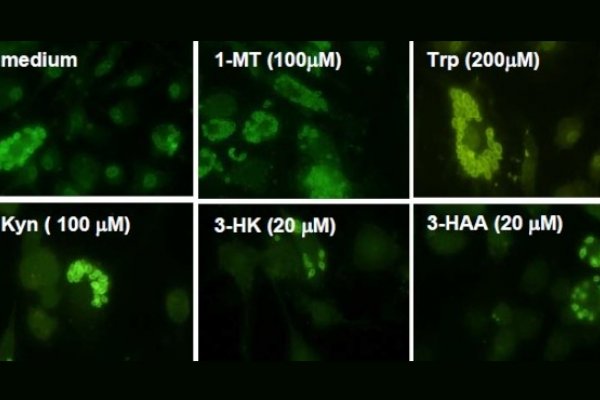 Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa
Células Presentadoras de Antigeno como Reguladoras de la Respuesta Inmune Innata y Adaptativa