Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
-
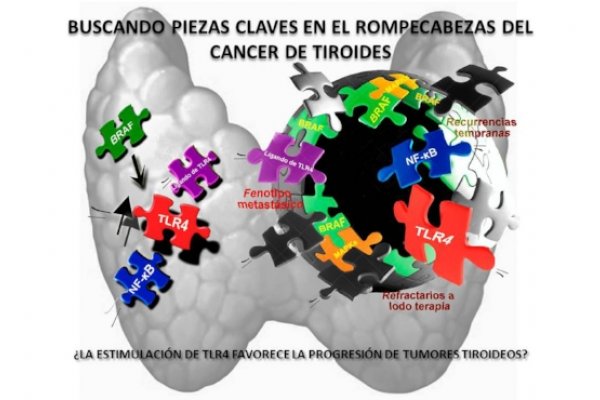 Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
-
 Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
-
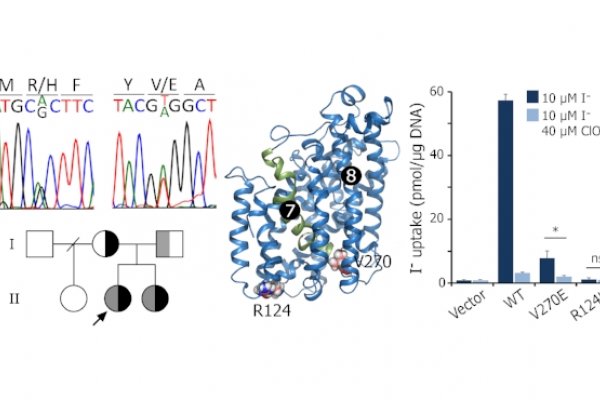 Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
-
 Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides
Mecanismos moleculares involucrados en la fisiología y patología de la glándula tiroides